De nierfunctie neemt af met de leeftijd. Door vergrijzing zijn er dan ook steeds meer mensen met chronische nierschade. Wat moet je als verpleegkundige hierover weten? De toets bij dit artikel levert 2 accreditatiepunten op.
In deze Challenge over chronische nierschade leer je:
- wat risicofactoren zijn voor chronische nierschade
- hoe chronische nierschade wordt gediagnosticeerd
- welke metabole complicaties op kunnen treden bij nierschade
- welke behandelingen mogelijk zijn bij nierfalen
De toets bij dit artikel is niet meer beschikbaar. Eerder behaalde accreditatiepunten blijven gewoon geldig.
tekst artikel: Elles Lalieu
illustratie: Fotalia
toets: Anna-Marie Mollink
Meneer Goossens (68) komt met hartklachten bij de huisarts. Hij is al enige tijd kortademig en heeft vaak hoofdpijn en hartkloppingen. Bij de laatste controle was zijn bloeddruk aan de hoge kant. De huisarts vertrouwt het niet en laat een uitgebreid bloed- en urineonderzoek uitvoeren.
Chronische nierschade (CNS) geeft in een vroeg stadium meestal geen klachten. Patiënten komen, net als de man in het voorbeeld, bij de huisarts omdat zij ergens anders last van hebben. ‘Als verpleegkundige is het belangrijk je ervan bewust te zijn dat iedereen nierschade kan hebben’, stelt Margreet Dirks. Zij is verpleegkundig specialist interne geneeskunde en dialyse aan het Maasstad ziekenhuis in Rotterdam. ‘Bij een patiënt met hypertensie, diabetes of vaatlijden gaan bij mij de alarmbellen rinkelen. Dan laat ik regelmatig (ongeveer jaarlijks) de nierfunctie controleren’.
Oorzaken van nierschade
Nierschade kent vele oorzaken. In ongeveer een kwart van de gevallen is er sprake van een (erfelijke) ziekte1, maar meestal is er iets anders aan de hand. De nierfunctie neemt af met de leeftijd. Door vergrijzing zijn er dan ook steeds meer patiënten (ongeveer 12% van de Nederlanders2 en 13% van de Vlamingen3) met CNS.
Naast leeftijd spelen leefstijl en medicijngebruik een rol. Rokers, patiënten met hoge bloeddruk, diabetes of ernstig overgewicht hebben een verhoogde kans op nierschade. Ook mensen die dagelijks vijf of meer verschillende medicijnen gebruiken lopen risico. Sommige medicijnen zijn toxisch voor de nieren (NSAID’s, aminoglycosiden en sommige oncolytica). Andere kunnen bij verminderde nierklaring opstapelen en zorgen voor toxische effecten (metformine en allopurinol).4
Bloed- en urineonderzoek
Door de hierboven genoemde oorzaken ontstaat schade aan het nierweefsel. Die schade zorgt ervoor dat de nieren hun filterfunctie steeds slechter kunnen uitvoeren. De arts schat de nierfunctie (eGFR, estimated Glomerular Filtration Rate) aan de hand van de CKD-EPI formule. Deze formule maakt gebruik van het serumcreatininegehalte en houdt rekening met ras, leeftijd en geslacht. Bij gezonde mensen ligt de eGFR op minstens 90 ml/min/1,73 m2. Uit het bloedonderzoek blijkt dat de eGFR van meneer Goossens is afgenomen naar 63 ml/min/1,73 m2.
De estimated Glomerular Filtration Rate (eGFR) is een schatting van de nierfunctie, bij gezonde mensen is die 90 ml/min/1,73 m2 of hoger
Kapotte nierfilters laten grotere moleculen door (zoals eiwitten), die terechtkomen in de urine. Proteïnurie is dus een tweede belangrijke aanwijzing voor nierschade. De arts kijkt in eerste instantie vooral naar albumine, een klein eiwit dat al bij minimale beschadiging door de filters heen kan lekken. Bij albuminurie bepaalt het laboratorium ook een albumine/creatinine ratio (ACR), die iets zegt over de hoeveelheid albumine en creatinine in de urine. Bij gezonde mensen ligt de ratio op minder dan 3 mg/mmol. Meneer Goossens heeft een ratio van 25 mg/mmol.
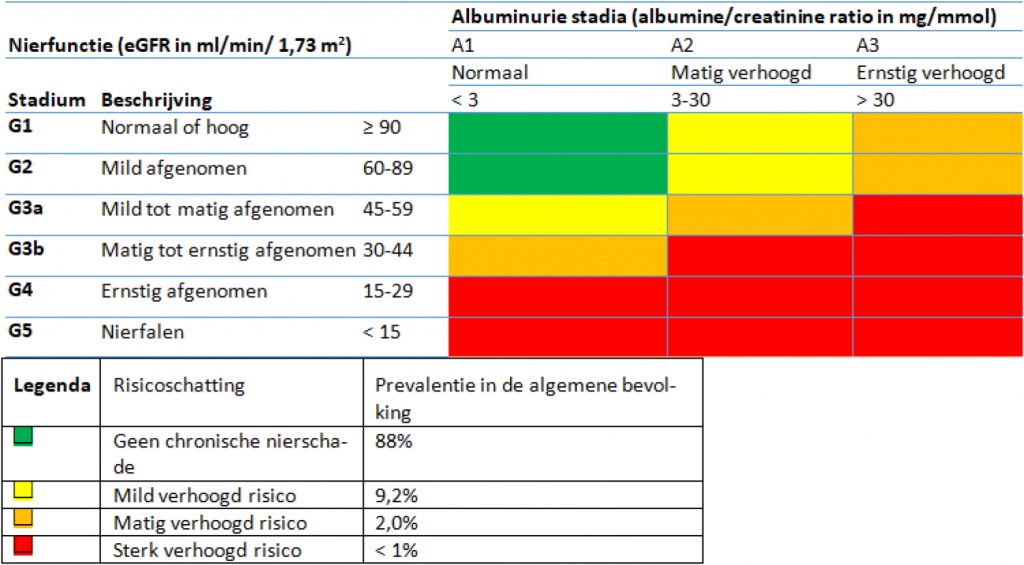
Stadia van nierschade
Zowel de eGFR als het urineonderzoek wijst op nierschade bij meneer Goossens. Toch mag de huisarts op dit moment die diagnose nog niet stellen. Pas als functie- en/of urineonderzoek 3 maanden of langer afwijkende waarden laten zien, spreken we van chronische nierschade. Na 3 maanden herhaalt de huisarts beide onderzoeken, met een vergelijkbaar resultaat. Hij kan meneer nu indelen in 1 van de 5 stadia van chronische nierschade (zie tabel).
Met een eGFR van 63 ml/min/1,73 m2 en een ACR van 25 mg/mmol valt meneer in categorie G2 (zie schema Stadia van nierschade). Dat betekent dat hij een mild verhoogd risico heeft op overlijden, cardiovasculaire schade en progressie van de nierschade.
Stadia van nierschade2
Leefstijladviezen bij chronische nierschade
Om verdere schade aan de nieren te voorkomen, moet de bloeddruk van meneer Goossens omlaag. Leefstijladviezen zijn vaak de eerste interventie. ‘Een zoutbeperkt dieet (maximaal 6 gram zout per dag) komt bijvoorbeeld vaak voor’, vertelt Dirks.
Daarnaast is het belangrijk om het medicijngebruik in de gaten te houden. In Nederland is de huisarts verplicht om de actuele eGFR, met toestemming van de patiënt, door te geven aan de apotheek. In België geldt dit niet. Verder moeten patiënten oppassen met middelen die vrij verkrijgbaar zijn, zoals NSAID’s. Als pijnstilling heeft paracetamol de voorkeur.
Behandeling
Bij meneer Goossens blijken leefstijladviezen alleen niet voldoende te helpen. Hij krijgt antihypertensiva in de vorm van een RAAS-remmer om cardiovasculaire schade te voorkomen. RAAS-remmers (zoals enalapril, captopril of losartan) hebben als voordeel dat ze, via een nog onbekend mechanisme, eiwitverlies door de nier tegengaan. RAAS-remmers verhogen de kans op hyperkaliëmie. Daarom kunnen deze medicijnen niet gecombineerd worden met kaliumsparende diuretica (eplerenon, spironolacton en triamtereen).
Door kapotte nierfilters komen grotere moleculen (zoals eiwitten) in de urine; proteïnurie is dan ook een aanwijzing voor nierschade
Bij het opstarten van RAAS-remmers zal de arts zowel het kaliumgehalte als de eGFR iedere 1 tot 2 weken controleren totdat de patiënt stabiel is. Als het kaliumgehalte in het bloed hoger wordt dan 5,5 tot 6 mmol/l of als de eGFR met meer dan 20% (Nederland) tot 25% (België) daalt, zal de arts overwegen om de behandeling te staken of de dosering te halveren.
Hyperkaliëmie
Meneer Goossens doet erg zijn best om zich aan de leefstijladviezen te houden. Hij eet minder zout en vaker groente en fruit. Toch lukt het niet om zijn bloeddruk onder controle te krijgen. Twee jaar later meldt hij zich opnieuw bij de huisarts. Dit keer met klachten van oververmoeidheid, een slap gevoel en tintelingen in de armen.
De huisarts vraagt nieuw onderzoek aan. Hij kijkt nu niet alleen naar de eGFR en de ACR, maar ook naar de hoeveelheid fosfaat, kalium, calcium en hemoglobine in het bloed. Afwijkingen kunnen duiden op een metabole complicatie (zie kader). Uit het nieuwe onderzoek blijkt dat de eGFR is afgenomen tot 21 ml/min/1,73 m2. De ACR is gestegen naar 34 mg/mmol. Daarnaast is er sprake van een hyperkaliëmie.
Gezonde mensen scheiden bijna al het kalium dat ze via de voeding binnenkrijgen uit via de nieren. Bij patiënten met CNS is die uitscheiding verminderd en dus lopen zij risico op hyperkaliëmie.
‘Bij de behandeling van hyperkaliëmie is een kaliumbeperkt dieet bijna altijd noodzakelijk’, legt Dirks uit. ‘Kalium zit onder andere in groeten, fruit en noten. Als verpleegkundige let je erop dat de patiënt niet te veel groenten en fruit eet. Dat is in het begin wennen, want zo’n advies gaat toch een beetje tegen je gezonde gevoel in’.
Omdat RAAS-remmers het risico op hyperkaliëmie verhogen, krijgt meneer Goossens andere antihypertensiva (thiazidediuretica) voorgeschreven. Deze medicatie verhoogt de uitscheiding van kalium. Mocht dat nog niet voldoende zijn, dan kan de arts besluiten om ook kaliumbinders (bijvoorbeeld calciumpolystyreensulfonaat (Sorbisterit®)) te gaan geven. Meneer neemt deze medicijnen in iedere keer nadat hij iets met kalium heeft gegeten. De kaliumbinders slaan goed aan. De eGFR herstelt zich tot 25 ml/min/1,73 m2.
Jeuk
Naast kalium kunnen ook andere afvalstoffen zich ophopen in het bloed, bijvoorbeeld fosfaat. Er is dan sprake van hyperfosfatemie. Het neerslaande fosfaat veroorzaakt verkalkingen in de huid, bloedvaten en het hart. De verkalkingen in de huid zorgen bij veel patiënten voor moeilijk behandelbare jeuk. ‘Zolang de bloedwaarden niet verbeteren, blijven deze klachten bestaan’, zegt Dirks.
Door ophoping van fosfaat in het bloed kunnen verkalkingen in de huid ontstaan, die moeilijk behandelbare jeuk veroorzaken2
Behandeling met fosfaatbinders zoals calciumacetaat/magnesiumcarbonaat (Osvaren®), ferrioxidesaccharaat (Velphoro®), lanthaancarbonaat (Fosrenol®), selvelameer (Renvela®) kan uitkomst bieden. ‘Bij aanhoudende klachten kunnen patiënten worden doorverwezen naar de dermatoloog voor UVB lichttherapie’. Lichttherapie remt ontstekingsreacties in de huid en herstelt de opperhuid.
Vochtbalans
Bij sommige patiënten met CNS loopt de urineproductie terug tot minder dan 400 ml per dag (oligurie). Dirks: ‘Bij patiënten met oligurie is het extra belangrijk om de vochtbalans heel secuur te bepalen. De patiënt mag niet te veel vocht binnenkrijgen, dan kan overvulling optreden, wat kan leiden tot oedeem, hypertensie en benauwdheid. Te weinig vocht is ook niet goed. Ondervulling kan leiden tot duizeligheid, hypotensie en krampen in voeten of benen.’
 Meer punten verdienen?
Meer punten verdienen?
Maak ook de andere Nursing Challenge toetsen, je vindt ze via de Challenge-pagina.
Nierfalen
Nierfalen is het laatste stadium van CNS, waarbij de eGFR is afgenomen tot minder dan 15 ml/min/1,73 m2. Van alle patiënten met CNS bereikt ongeveer 1% het eindstadium nierfalen.5 Een patiënt met nierfalen heeft nierfunctievervangende therapie nodig om in leven te blijven: niertransplantatie, hemodialyse of peritoneale dialyse. Vaak krijgen patiënten met stadium 4 CNS al het advies om na te gaan denken over nierfunctievervangende therapie of een conservatieve behandeling.
Patiënten met nierschade scheiden onvoldoende kalium uit via de nieren, daardoor kan hyperkaliëmie ontstaan
‘We hopen altijd op een niertransplantatie, maar soms is dat geen optie’, vertelt Dirks. ‘Bijvoorbeeld omdat een patiënt te ziek is om geopereerd te worden. Of omdat hij een erfelijke nierziekte heeft, die terug kan komen in de donornier. Of omdat het niet lukt om een geschikte donor te vinden. Dan is dialyse de enige optie’.
Dialyse
Bij peritoneale dialyse neemt het buikvlies de filterfunctie van de nieren over. Er is een operatie nodig om een peritoneale-dialyse (PD) katheter te plaatsen. Via de PD-katheter stroomt dialysevloeistof (gezuiverd water met toegevoegde elektrolyten) de buik in. Afvalstoffen komen vanuit het bloed in de spoelvloeistof terecht via het buikvlies.
Nierfalen is het laatste stadium van chronische nierschade; de eGFR is dan afgenomen tot minder dan 15 ml/min/1,73 m
De plek waar de PD-katheter de buik uitkomt, heet de huidpoort. De huidpoort is gevoelig voor ontsteking. Een ontsteking kenmerkt zich door afscheiding, vaak in combinatie met erytheem (meer dan tweemaal de diameter van de katheter), zwelling en hypergranulatie. Bij tekenen van ontsteking moet de patiënt direct contact opnemen met het dialysecentrum.
Hemodialyse vereist de aanleg van een shunt tussen een slagader en een ader. Door die verbinding stroomt er meer bloed naar de ader, wat de veneuze bloeddruk doet toenemen. De verwijding die hierdoor ontstaat, maakt dat de ader makkelijker is aan te prikken met dialyseren. ‘Belangrijk bij een shunt is dat de arm niet gebruikt wordt voor injecties (intraveneus, intramusculair en subcutaan), venapunctie en tensiemeting’, zegt Dirks. ‘Ook is het verstandig de betreffende arm niet voor deze doeleinden te gebruiken vanaf het moment dat duidelijk is dat er een shunt komt. Zo blijven de bloedvaten in de best mogelijke toestand en kan de shunt zo lang mogelijk blijven zitten’.
Met dank aan Jan Donck, nefroloog aan het AZ Sint-Lucas in Gent
Gebruikte literatuur
1 Handreiking erfelijke nieraandoeningen en urinewegafwijkingen en nefrologische verwijsindicaties klinische genetica, 2018. Nederlandse federatie voor nefrologie.
2 Richtlijn diagnostiek en beleid bij volwassenen met chronische nierschade (CNS), 2018. Nederlandse Internisten Vereniging, Nederlands Huisartsen Genootschap.
3 Vlaamse INTEGO databank, met gegevens van ruim 280.000 patiënten die met klachten bij de huisarts kwamen, 2012.
4 Een complete lijst met medicijnen die invloed hebben op de nierfunctie is te vinden via www.apotheekkennisbank.nl/system/files/free/nierfunctie_201303.pdf.
5 Richtlijn nierfunctievervangende therapie, 2016. Nederlandse Internisten Vereniging.
– Van Pottelbergh G, Van Heden L, Maes S, Jamar S, Smets S, Claes K. Chronische nierschade: Aandachtspunten voor clinici. UZ Leuven, 2010.
– www.uzleuven.be/sites/default/files/IG_nefrologie/chronische_nierschade_v09_lowresDEF.pdf
Blijft chronische nierschade te lang onopgemerkt of onbehandeld, dan kunnen metabole complicaties ontstaan. De belangrijkste complicaties zijn:Metabole complicaties bij chronische nierschade
Bij acute nierschade is de nierfunctie plotseling erg verslechterd. Dit kan het gevolg zijn van shock, sepsis, ernstig bloedverlies of medicijngebruik. NSAID’s en sommige antibiotica en chemotherapeutica kunnen acute nierschade veroorzaken. Vaak is opname op de intensive care noodzakelijk. Daar krijgt de patiënt een dialysekatheter in een grote ader in de lies, hals of bij het sleutelbeen. Daardoor is dialyse of continue venoveneuze hemofiltratie (CVVH) mogelijk. De dialysekatheter mag alleen verzorgd worden door de dialyseverpleegkundige. Andere verpleegkundigen komen over het algemeen pas met deze patiënten in aanraking als acute nierschade overgaat in chronische nierschade.Acute nierschade
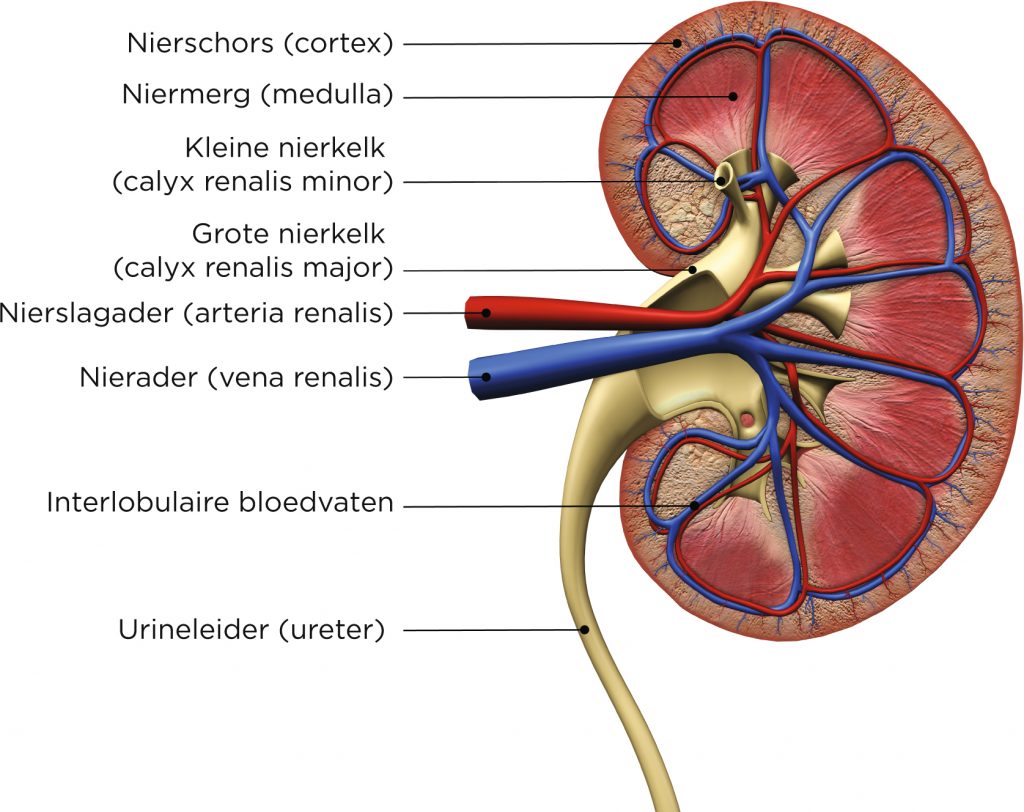
De nieren liggen retroperitoneaal, links en rechts van de wervelkolom. De rechternier bevindt zich onder de lever en ligt daardoor iets lager dan de linkernier. De nieren spelen een belangrijke rol bij het verwijderen van afvalstoffen uit het bloed en hebben daarnaast een functie in de homeostase. OpbouwAnatomie en fysiologie van de nieren
Een nier is opgebouwd uit een buitenlaag (de cortex) en een binnenlaag (de medulla). In de nier liggen ongeveer een miljoen nefronen. Dit zijn de functionele eenheden van de nier. Bloed komt de nefronen binnen via de nierslagader (arteria renalis). De slagader mondt uit in een kluwen van haarvaten, de glomerulus.
 Elk nefron heeft een glomerulus. Dat is de plek waar filtratie plaatsvindt. Eiwitten en bloedcellen blijven achter, terwijl water met opgeloste stoffen verder door de afvoerende nierkanaaltjes (tubuli) stroomt. In de tubuli (bestaande uit de proximale tubulus, lis van Henle en distale tubulus) wordt het grootste deel van het glomerulusfiltraat weer opgenomen in het bloed (resorptie). Het gaat dan vooral om water, glucose en zouten.
Elk nefron heeft een glomerulus. Dat is de plek waar filtratie plaatsvindt. Eiwitten en bloedcellen blijven achter, terwijl water met opgeloste stoffen verder door de afvoerende nierkanaaltjes (tubuli) stroomt. In de tubuli (bestaande uit de proximale tubulus, lis van Henle en distale tubulus) wordt het grootste deel van het glomerulusfiltraat weer opgenomen in het bloed (resorptie). Het gaat dan vooral om water, glucose en zouten.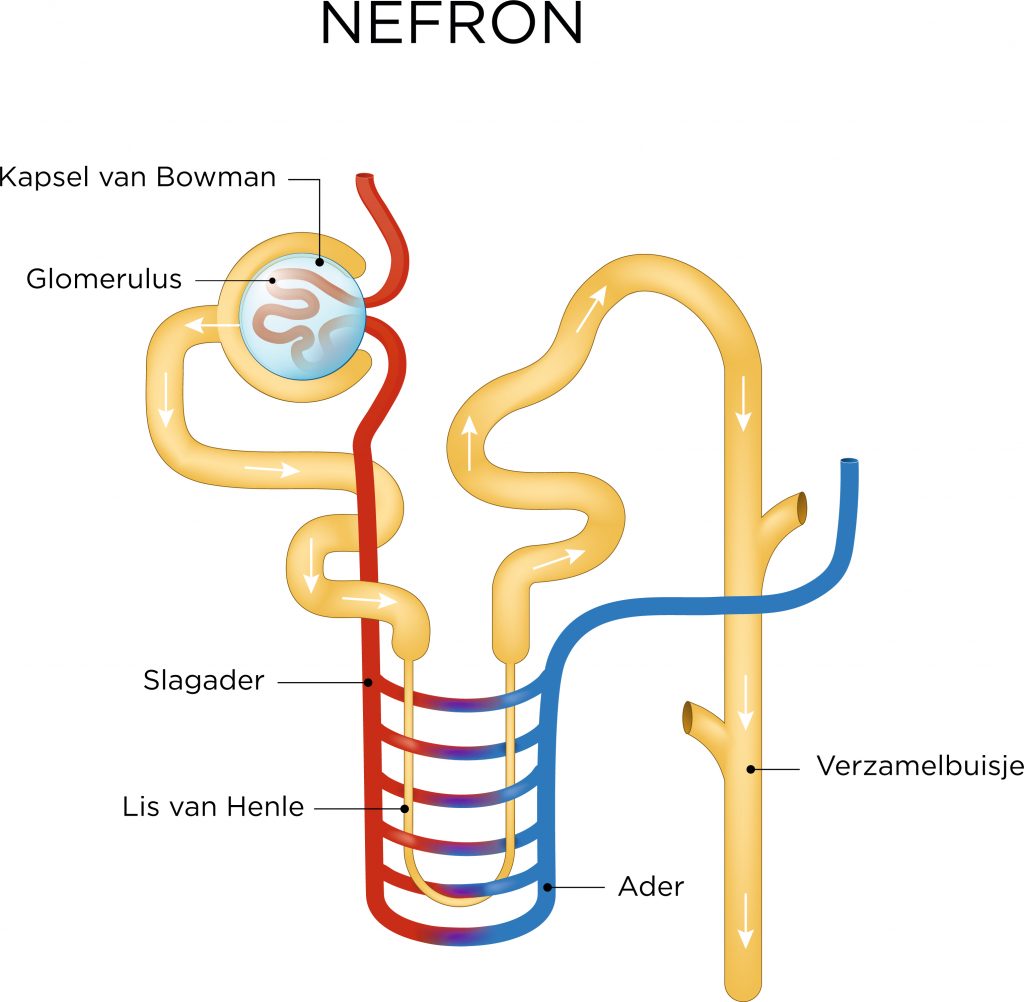 Wat overblijft is urine. Daarin bevinden zich afvalstoffen zoals ureum en creatinine. Urine komt samen in het nierbekken (pyelum) en stroomt vervolgens via de urineleider (ureter) naar de blaas. Gefilterd bloed verlaat de nieren via de nierader (vena renalis).
Wat overblijft is urine. Daarin bevinden zich afvalstoffen zoals ureum en creatinine. Urine komt samen in het nierbekken (pyelum) en stroomt vervolgens via de urineleider (ureter) naar de blaas. Gefilterd bloed verlaat de nieren via de nierader (vena renalis).
Toets je kennis
Zoek je verdieping in je vak, doe dan mee aan de Nursing Challenge: online kennistoetsen over twee vakinhoudelijke artikelen
Hoe het werkt
-
Iedere maand verschijnen in Nursing magazine en op Nursing.nl twee artikelen waaraan een kennistoets is verbonden: een artikel over een verpleegkundig onderwerp en een medicijnartikel
-
Met de eerste toets verdien je 2 accreditatiepunten en met de tweede 1. Per jaar kun je dus 33 accreditatiepunten verdienen (Nursing verschijnt 11 keer per jaar)
-
Alle toetsen staan online op www.nursing.nl/challenge
Win leuke prijzen!
-
Per maand wordt onder alle deelnemers een goodiebag verloot
-
Aan het eind van het jaar winnen de drie beste deelnemers mooie prijzen
-
De winnaars worden elke maand online bekendgemaakt
Voorbeeldvraag Chronische nierschade
Bij renale anemie produceren de nieren te weinig van een bepaald hormoon. Welk hormoon is dat?
A Adrenaline
B Erytropoëtine
C Renine
D Calcitriol
E Aldosteron
De toets bij dit artikel is niet meer beschikbaar. Eerder behaalde accreditatiepunten blijven gewoon geldig.